 |
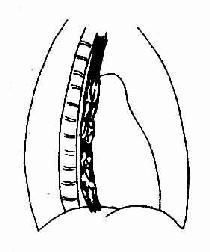
贲门痉挛-放射诊断学
本病病因尚未完全明了,但因发现其食管下段肠肌丛(奥氏神经丛)的神经节细胞变性和数量减少,多认 |

 |
贲门痉挛-放射诊断学
本病病因尚未完全明了,但因发现其食管下段肠肌丛(奥氏神经丛)的神经节细胞变性和数量减少,多认 |
   |
-
抗Hp药物设计重要靶点晶体结构被成功解析 |
| 作者:佚名 文章来源:医学教育网 点击数: 更新时间:2010/3/6 |
|
中国科学院上海药物研究所沈旭研究员领导的课题组与蒋华良研究员领导的课题组合作,最近成功解析了抗幽门螺杆菌(Hp)药物设计的重要靶点——二氨基庚二酸脱羧酶(DAPDC)晶体,其研究成果发表在美国《生物化学杂志》上。
幽门螺杆菌是消化道溃疡、胃腺癌以及胃淋巴癌的主要诱因,其有效的药物治疗是消化病学研究的一个热点。然而,抗生素的滥用等使得幽门螺杆菌对现有疗法的耐药性越来越高,发现新型抗菌药物迫在眉睫。针对细菌独有代谢途径中的关键酶设计与开发药物已成为抗菌药物研究的一条重要途径,DAPDC就是这样一个理想的靶标。
DAPDC属于IV型磷酸吡哆醛(PLP)依赖性酶,它催化二氨基庚二酸脱羧形成-赖氨酸,是细菌赖氨酸合成途径中的最后一步。研究人员针对幽门螺杆菌的DAPDCL进行了结构功能研究,首次获得了HpDAPDC与PLP及反应产物L-lysine的复合物晶体,并解析了其结构。结果发现这是DAPDC酶家族的第一个反应中间态结构,即反应产物L-赖氨酸与辅酶PLP共价结合形成了外源醛亚胺的构象,为了解DADPC的底物结合情况及催化机理提供了迄今为止最详细深入的结构信息,也为针对DAPDC设计特异性抑制剂提供了宝贵的线索。
另外,研究还发现,与其他DAPDC的结构不同,HpDAPDC的活性口袋被一盖子完全封闭。研究人员通过比较推测认为,此盖子在酶催化的反应过程中会发生“打开”-“关闭”的构象变化,以稳定催化中间态及释放产物,结果通过相应的突变体酶催化活性测定与结构解析给予了有力的证明。这一发现强调了诱导契合的催化方式在IV型PLP酶催化机理中的重要地位,对设计特异性HpDAPDC抑制剂具有提示意义。
|
| 【发表评论】【加入收藏】【告诉好友】【打印此文】【关闭窗口】 |
- 上一个文章: 研究称常食玉米油可降低血胆固醇并软化血管
- 下一个文章: 俄罗斯专家发明冷冻液态氮治疗恶性肿瘤技术
|
|
没有相关文章
|
|
|














